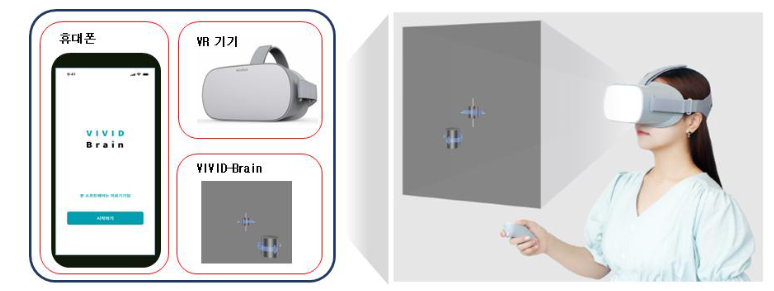
디지털치료기기 1년만에 추가…식약처, 3호·4호 허가
메디칼타임즈=허성규 기자식품의약품안전처(처장 오유경)는 뉴냅스의 인지치료소프트웨어(제품명: VIVID Brain)와 쉐어앤서비스의 호흡재활소프트웨어(제품명: EasyBreath) 2종을 국내 제3, 4호 디지털치료기기로 허가했다고 4월 19일 밝혔다.디지철 치료기기는 의학적 장애나 질병을 예방·관리·치료하기 위해 환자에게 과학적 근거를 기반으로 치료적으로 개입하는 소프트웨어 의료기기를 말한다.허가된 두 품목은 모바일 앱으로 구현한 소프트웨어 의료기기로, △'VIVID Brain'은 뇌 질환으로 인한 시야장애 환자에게 12주간 반복적인 시지각 학습훈련을 제공해 좁아진 시야를 개선하고, △'EasyBreath'는 만성폐쇄성질환, 천식, 폐암 등 환자에게 8주간 맞춤형 호흡 재활훈련을 제공해 유산소 운동능력과 호흡 곤란 증상을 개선한다.식약처는 두 제품의 개발부터 임상시험 설계까지 밀착 지원했으며, 과학적이고 철저한 심사를 거쳐 허가했다.또한, 혁신성과 임상적 유효성 등을 인정하여 혁신의료기기로 지정하고 '통합심사·평가 제도'를 통해 실제 의료현장에 신속하게 사용될 수 있도록 지원하고 있다.오유경 식약처장은 "이번 허가는 디지털치료기기가 질병 치료뿐 아니라 장애를 경감하는 데도 활용될 수 있음을 보여주는 사례"라며 "디지털치료기기가 질병이나 장애로 어려움을 겪는 환자의 삶의 질 향상에 도움을 줄 수 있을 것으로 기대한다"고 말했다.아울러 "앞으로도 국내업체가 세계시장을 선도하는 신기술 혁신 제품을 계속해서 개발할 수 있도록 국내 규제를 글로벌스탠다드로 만들겠다"며, "규제 전문가 밀착 상담, 선제적 기준 마련 등 규제지원 다리를 단단하게 놓아 제품 출시를 앞당기고 다양한 질환에 디지털치료기기가 활용될 수 있도록 하겠다"고 강조했다.한편 식약처는 앞으로도 국민께서 안심하고 사용할 수 있는 안전하고 효과 있는 디지털치료기기가 신속하게 제품화될 수 있도록 최선을 다하겠다고 밝혔다.